Rangkuman Kimia Kelas 10 Bab Stoikiometri ~ sekolahmuonline.com
Rangkuman Kimia Kelas 10 Bab Stoikiometri ~ sekolahmuonline.com. Pembaca Sekolahmuonline, berikut Sekolahmuonline sajikan rangkuman atau ringkasan mata pelajaran Kimia Kelas X Bab Stoikiometri. Silahkan dibaca dan dipelajari, semoga membantu mempermudah pembaca Sekolahmuonline semuanya dalam mengingat-ingat materi Kimia khususnya Bab Stoikiometri.
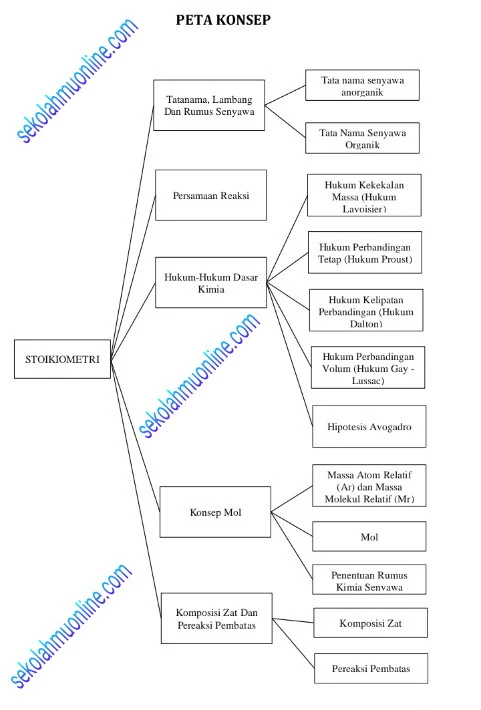
Kimia Kelas 10 Bab Stoikiometri membahas lima Kegiatan Pembelajaran, yaitu:
• Kegiatan Pembelajaran Pertama: Tata Nama, Lambang Dan Rumus Senyawa
• Kegiatan Pembelajaran Kedua: Persamaan Reaksi
• Kegiatan Pembelajaran Ketiga: Hukum-Hukum Dasar Kimia
• Kegiatan Pembelajaran Keempat: Konsep Mol
• Kegiatan Pembelajaran Kelima: Komposisi Zat dan Pereaksi Pembatas
Rangkuman Kimia Kelas X Bab Stoikiometri
Sebelum masuk ke rangkuman atau ringkasan Bab Stoikiometri, silakan baca istilah-istilah yang mungkin akan sering Anda jumpai ketika membahas Bab ini. Sehingga, Anda menjadi tidak asing lagi dengan istilah-istilah yang ada. Hal ini tentu akan memudahkan Anda dalam mempelajari Kimia khususnya Bab Stoikiometri.
- Keadaan standar (STP): keadaan suhu 0 ⁰C dan tekanan 1 atmosfer
- Koefisien reaksi: angka yang terdapat di depan rumus kimia dalam suatu persamaan reaksi.
- Massa atom relatif: Perbandingan massa atom dengan suatu unsur terhadap 1/12 massa atom C-12.
- Massa molekul relatif: jumlah massa relatif semua atom dalam molekul.
- Mol: kuantitas zat yang mempunyai massa (dalam gram) sebanyak massa atom/molekul relatifnya.
- Pereaksi: zat yang berubah selama reaksi dan ditulis di sebelah kiri persamaan reaksi.
- Pereaksi pembatas: pereaksi yang habis lebih dahulu dan membatasi jalannya reaksi sehingga tidak ada reaksi lebih lanjut.
- Persamaan reaksi: suatu persamaan yang menggambarkan zat-zat kimia yang terlibat sebelum dan sesudah reaksi kimia, baik secara kualitatif maupun kuantitatif.
- Rumus empiris: menyatakan perbandingan terkecil atom-atom dalam senyawa.
- Rumus molekul: menyatakan jumlah atom-atom dalam senyawa, merupakan kelipatan dari rumus empirisnya
Nah, berikut ini rangkuman Kimia kelas X Bab Stoikiometri. Rangkuman sebagaimana sumber rujukannya disajikan per kegiatan pembelajaran. Selamat membaca.
A. Rangkuman Kegiatan Pembelajaran 1: Tata Nama, Lambang Dan Rumus Senyawa
1. Tata nama senyawa anorganik dikelompokkan menjadi:
a. Tata nama senyawa kovalen
b. Tata nama senyawa ion
c. Tata nama senyawa asam
d. Tata nama senyawa basa
e. Tata nama senyawa garam
2. Tata nama senyawa biner dari non logam dan non logam yaitu:
Nama non logam 1 – nama non logam 2 - ida
3. Jika pasangan unsur yang bersenyawa membentuk lebih dari satu jenis senyawa, maka senyawa-senyawa itu dibedakan dengan menyebutkan angka indeks dalam bahasa Yunani.
4. Nama indeks 1 (mono) di depan tidak perlu disebutkan.
5. Tata nama senyawa ion : Nama kation – nama anion
6. Tata nama senyawa asam : Asam – nama sisa asam/nama anion
7. Tata nama Basa : Nama kation – hidroksida
8. Tata nama garam : Nama kation – nama anion
B. Rangkuman Kegiatan Pembelajaran 2: Persamaan Reaksi
1. Pada suatu reaksi kimia terdapat zat pereaksi (reaktan) dan hasil reaksi (produk).
2. Jumlah atom unsur reaktan (ruas kiri panah) harus sama dengan jumlah atom unsur produk (ruas kanan panah).
3. Cara menghitung jumlah atom unsur menggunakan rumus indeks dikalikan koefisien.
4. Urutan atom yang disetarakan adalah atom logam – atom non logam selain H dan O – atom H – atom O.
5. Untuk menyetarakan reaksi-reaksi yang cukup sulit, dapat memakai “metode abjad”
C. Rangkuman Kegiatan Pembelajaran 3: Hukum-Hukum Dasar Kimia
1. Hukum Kekekalan Massa (Hukum Lavoisier) berbunyi jumlah massa zat-zat sebelum dan sesudah reaksi adalah sama.
Zat A + Zat B → Zat C
Massa A + B = massa C
2. Hukum Perbandingan Tetap (Hukum Proust) berbunyi perbandingan massa unsur-unsur penyusun dalam tiap senyawa selalu tetap.
Unsur A + Unsur B → Senyawa C
Massa A: massa B selalu tetap membentuk senyawa C
3. Hukum Kelipatan Perbandingan (Hukum Dalton) berbunyi jika ada dua senyawa yang dibentuk dari dua unsur yang sama dan massa satu unsur pada kedua senyawa itu sama maka massa unsur yang lainnya mempunyai angka perbandingan yang sederhana dan bulat.
Unsur A + Unsur B → Senyawa I
: AB
Senyawa II
: A2B3
Massa unsur A sama, maka massa unsur BI : BII = 2 : 3
4. Hukum Perbandingan Volum (Hukum Gay Lussac) berbunyi pada temperatur dan tekanan yang sama perbandingan volum gas-gas yang bereaksi dan gas hasil reaksi merupakan bilangan bulat dan mudah.
1 volum gas A + 1 volum gas B → 2 volum gas C
Volum A : Volum B : Volum C = 1 : 1 : 2
5. Hukum Avogadro berbunyi pada temperatur dan tekanan yang sama, semua gas pada volum yang sama mengandung jumlah molekul yang sama pula.
P dan T sama: A2 + B2 → 2AB
Jumlah molekul A2: Jumlah molekul B2: Jumlah molekul AB = 1 : 1 : 2
D. Rangkuman Kegiatan Pembelajaran 4: Konsep Mol
1. Massa atom relatif
2. Massa molekul relatif (Mr) merupakan jumlah massa atom relatif unsur-unsur pembentuk satu molekul suatu senyawa.
3. Satuan jumlah zat dalam kimia adalah mol.
4. Hubungan mol dengan besaran lainnya digambarkan dalam suatu Jembatan Mol.
5. Volume gas dipengaruhi oleh suhu dan tekanan.
6. Kondisi dengan suhu 0 °C dan tekanan 1 atm disebut keadaan standar dan dinyatakan dengan STP (Standard Temperature and Pressure).
7. Kondisi pengukuran gas pada suhu 25 °C dan tekanan 1 atm disebut keadaan kamar dan dinyatakan dengan RTP (Room Temperature and Pressure).
8. Volume gas pada suhu dan tekanan yang diketahui dapat dihitung dengan menggunakan persamaan gas yang disebut persamaan gas ideal, yaitu PV = nRT.
9. Pada suhu dan tekanan yang sama, volume gas hanya bergantung pada jumlah molnya.
10. Suatu senyawa mempunyai Rumus Empiris (RE) dan Rumus Molekul (RM).
11. Hubungan RE dan RM dinyatakan dengan rumus RM = (RE)n
5. Rangkuman Kegiatan Pembelajaran 5: Komposisi Zat dan Pereaksi Pembatas
1. Persen massa unsur dalam senyawa (%) = 𝑎𝑛𝑔𝑘𝑎 𝑖𝑛𝑑𝑒𝑘𝑠 𝑥 𝐴𝑟 𝑢𝑛𝑠𝑢𝑟/𝑀𝑟 𝑠𝑒𝑛𝑦𝑎𝑤𝑎 𝑥 100%
2. Air kristal merupakan molekul air yang terjebak di dalam suatu kristal. Kristal merupakan zat padat yang memiliki bentuk teratur.
3. Hidrat adalah zat padat yang mengikat beberapa molekul air sebagai bagian dari struktur kristalnya.
4. Dalam suatu reaksi kimia, pereaksi yang terlebih dulu habis bereaksi disebut sebagai pereaksi pembatas.
5. Langkah umum perhitungan zat dalam reaksi adalah buat persamaan reaksi setara --> ubah jumlah zat menjadi mol --> gunakan perbandingan koefisien = perbandingan mol untuk menghitung jumlah zat yang ditanyakan --> ubah mol zat ditanya menjadi besaran jumlah zat yang ditanyakan.
6. Cara menentukan pereaksi pembatas adalah mol masing-masing zat pereaksi dibagi koefisien, kemudian pilih hasil bagi yang kecil sebagai pereaksi pembatas.
Demikian postingan Sekolahmuonline yang menyajikan Rangkuman atau Ringkasan Kimia Kelas X Bab Stoikiometri. Rangkuman Sekolahmuonline rujuk dari Modul PJJ Kimia kelas X SMA. Semoga bermanfaat. Memudahkan seluruh rakyat Indonesia dalam belajar di mana saja dan kapan saja secara gratis. Silakan baca-baca postingan Sekolahmuonline yang lainnya.
Lengkap rangkuman atau ringkasan Kimia kelas X semua Bab. Silakan baca pada postingan-postingan di bawa ini (tinggal klik sesuai judul yang dibutuhkan):
- Rangkuman Kimia Kelas 10 Bab Pengenalan Ilmu Kimia ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Perkembangan Model Atom ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Konfigurasi Elektron ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Sifat-Sifat Periodik Unsur ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Ikatan Ion Dan Ikatan Kovalen ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Bentuk Molekul ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Interaksi Antar Molekul ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Daya Hantar Listrik Pada Larutan ~ sekolahmuonline.com.
- Rangkuman Kimia Kelas 10 Bab Reaksi Reduksi Dan Oksidasi ~ sekolahmuonline.com
- Rangkuman Kimia Kelas 10 Bab Stoikiometri ~ sekolahmuonline.com